蛋白激酶和磷酸酶对蛋白质的可逆磷酸化调节真菌细胞过程,包括代谢、转录和细胞周期。作为一种瞬时和可逆的翻译后修饰(PTM),磷酸化修饰执行着关键的分子开关功能,其对特定位点的靶蛋白保持严格的时空控制从而调控多种生物学进程。黄曲霉是一种腐生植物病原真菌,其产生的致癌物黄曲霉毒素可污染各种农业经济上重要的作物,如玉米、花生等。黄曲霉中的磷酸化蛋白参与多种生物学过程,丝氨酸磷酸化(pS)蛋白占比最高,达到81.1%,其次是苏氨酸磷酸化蛋白(pT;16.4%)。然而,很少有关于黄曲霉丝/苏氨酸型磷酸酶鉴定和功能的报道,其在黄曲霉中具体的分子功能和调控机制也太不清楚。
近日,十大网投官方入口澳门十大正规网投平台汪世华教授团队联合中国科学院水生生物研究所葛峰研究员课题组在国际知名期刊mBio(中科院一区,top)在线发表题为“PP2C Phosphatases Ptc1 and Ptc2 Dephosphorylate PGK1 to Regulate Autophagy and Aflatoxin Synthesis in the Pathogenic Fungus Aspergillus flavus”的研究论文。

该研究首次在黄曲霉菌中鉴定出七种PP2C型磷酸酶(Ptc1-7),功能分析表明,两种冗余的PP2C磷酸酶Ptc1和Ptc2是高度保守的并调节分生孢子发育、黄曲霉毒素合成,种子侵染和自噬小泡形成。Ptc1和 Ptc2蛋白定位在细胞质,然而在DNA损伤诱导自噬后两种蛋白均表现出核定位。进一步研究发现自噬诱导调控Ptc1和Ptc2蛋白在黄曲霉体内降解。与Mg2+配位的Asp残基对Ptc1和Ptc2磷酸酶活性、热稳定性以及生物学功能至关重要。为了深入探究黄曲霉菌Ptc1和Ptc2调控机制,基于IP-MS蛋白质相互作用组学,本研究鉴定到133个蛋白质与Ptc1和Ptc2共相互作用。KEGG通路富集分析表明,这些蛋白质与糖酵解/糖异生、碳代谢和吞噬体密切相关。在这些蛋白质中,磷酸甘油酸激酶1(PGK1)与Ptc1和Ptc2相互作用,在敲除Ptc1和Ptc2基因后,PGK1S203位点磷酸化修饰水平显著升高,并展现出明显的线粒体易位。此外,本研究发现PGK1 S203磷酸化水平影响黄曲霉毒素合成和自噬小泡形成。基于上述研究结果,本研究揭示PP2C型磷酸酶功能调控模型,即Ptc1和Ptc2的缺失显著增加PGK1的磷酸化。磷酸化的PGK1随后穿梭进入线粒体中,抑制黄曲霉线粒体代谢、自噬和黄曲霉毒素合成。
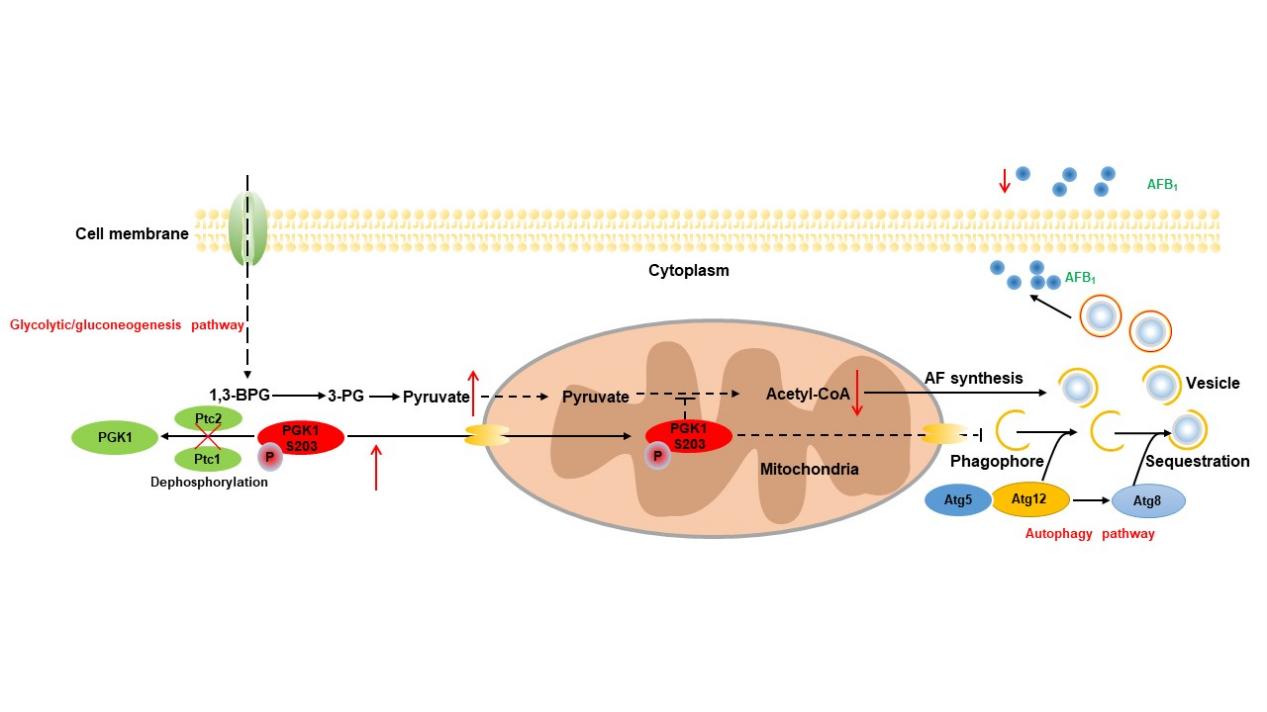
本研究评估了蛋白磷酸酶2C(PP2C)家族在病原真菌黄曲霉中是具有重要的生理功能。将为黄曲霉毒素污染早期防控提供理论参考依据。本研究也发现PP2C型磷酸酶在其他丝状病原真菌中同样存在并高度保守,其可作为潜在的药物作用靶点,为农业防治丝状病原真菌侵染并阻断其真菌毒力提供新思路。
十大网投官方入口为本研究第一完成单位,十大网投官方入口汪世华教授和中国科学院水生生物研究所葛峰研究员为论文共同通讯作者。十大网投官方入口2020级博士研究生朱卓为本研究论文第一作者,中国科学院水生生物研究所杨明坤老师、十大网投官方入口袁军教授、十大网投官方入口已毕业博士杨光(现为信阳师范大学讲师)、已毕业硕士张贝、曹晓红参与本研究工作。